Kariesbehandling med nanopartiklar för bättre tandhälsa
Orala bakterier uppstår så snart en tandhygienist eller tandläkare skrapar plakett från patientens tänder som behandling för tandförfall. Men genom att konsumera socker eller andra kolhydrater bygger bakterierna snabbt upp en seg och klibbig biofilm och producerar syror. Följaktligen attackerar de sedan tandemaljen och skapar hålrum i tänderna. Forskare rapporterar nu om en tandrötsbehandling som en dag kan förhindra att plack och hålrum bildas. En ny typ av cerium-nanopartikelförening används för detta. Således kommer varje tandläkare i hans praktik att kunna applicera medlet på tänderna.
Ny munhygien och tandförfall
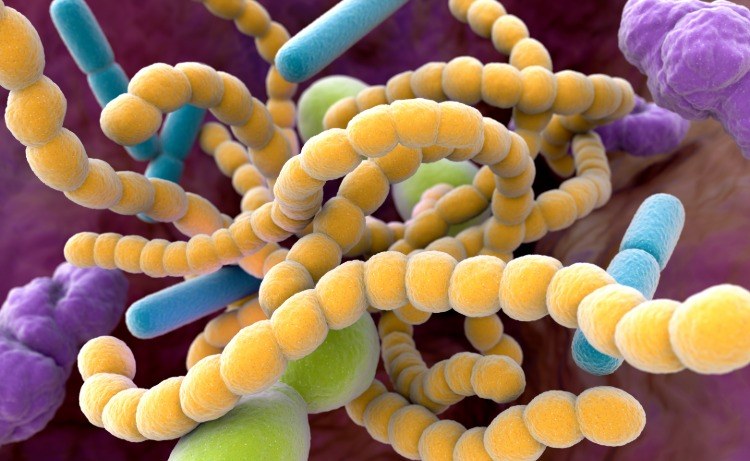
Munnen innehåller mer än 700 typer av bakterier. Dessa inkluderar fördelaktiga bakterier som hjälper till att smälta mat eller håller andra mikrober i schack. Men de inkluderar också skadlig halsfluss. Strax efter rengöring fastnar dessa bakterier vid tänderna och börjar föröka sig. Med socker som energikälla och byggsten bildar mikroberna gradvis en tuff film som människor inte helt enkelt kan borsta av. När bakterierna fortsätter att metabolisera socker, producerar de sura biprodukter som löser upp tandemaljen och banar väg för hålrum. Till exempel kan tandläkare och konsumenter slå tillbaka med fluor för att hämma plack och silvernitrat för att förhindra existerande tandförfall. Forskare har nu undersökt ett sätt med nanopartiklar av zinkoxid, kopparoxid eller silver för att behandla tandinfektioner.
Även om baktericider som dessa har sin plats inom tandvården, kan upprepade applikationer resultera i både färgade tänder och bakteriell resistens. Dessutom är dessa medel inte selektiva, så de dödar många godartade bakterier i munnen. Forskargruppen ville därför hitta ett alternativ som inte dödar bakterier i munnen urskillningslöst och förhindrar tandförfall, istället för att applicera sönderfallsbehandling efteråt. Så forskargruppen vände sig till ceria nanopartiklar. Andra team hade studerat effekterna av olika typer av ceria -nanopartiklar på mikrober, även om få hade studerat deras effekter på kliniskt relevanta bakterier under initiala förhållanden för biofilmbildning. De som gjorde detta gjorde sina nanopartiklar via oxidationsreducerande reaktioner eller pH-kontrollerade utfällningsreaktioner, eller köpte nanopartiklar från kommersiella källor. Dessa tidigare tillvägagångssätt hade emellertid antingen ingen effekt eller till och med främjade biofilmstillväxt i laboratorietester.
Perspektiv för tandvård
Nanopartiklarnas egenskaper och beteende beror därför delvis på deras tillverkning. Det gör detta genom att lösa ceriumammoniumnitrat eller sulfatsalter i vatten. Andra forskare tillverkade partiklarna på samma sätt men testade inte deras effekter på biofilmer. När forskarna sådde polystyrenplattor med streptokocker i tillväxtmedier och matade bakteriesockret i närvaro av ceriumoxid -nanopartikellösningen, fann de att föreningen minskade biofilmstillväxten med 40% jämfört med plattor utan nanopartiklar. Under liknande förhållanden visade emellertid silvernitrat, ett välkänt anti-void-medel, ingen effekt på biofilmstillväxten. Fördelen med tandrötsbehandling är att den verkar vara mindre skadlig för orala bakterier. I många fall bevarar detta de fördelaktiga bakterierna. Istället hindrade nanopartiklarna bara mikrober från att bilda vidhäftande biofilmer. Dessutom var toxiciteten och metaboliska effekterna av nanopartiklarna i humana orala celler i petriskålar lägre än silvernitrat.
Till exempel experimenterar teamet för närvarande med beläggningar för att stabilisera nanopartiklarna vid ett neutralt eller något basiskt pH. Forskarna kommer att fortsätta testa tandrötsbehandlingen i närvaro av andra bakteriestammar som vanligtvis finns i munnen. Detta gör att de kan testa effekterna på mänskliga celler i nedre matsmältningskanalen för att få en bättre känsla av patientens övergripande säkerhet.